क्या आपने कभी पानी की बोतल को कुछ घंटों के लिए तेज धूप में छोड़ दिया है और जब आपने उसे खोला तो हल्की "हिसिंग" की आवाज सुनी? यह वाष्प दाब नामक सिद्धांत के कारण होता है। रसायन विज्ञान में, वाष्प का दबाव एक बंद कंटेनर की दीवारों द्वारा लगाया जाने वाला दबाव होता है, जब उसमें मौजूद रासायनिक पदार्थ वाष्पित हो जाता है (गैस में बदल जाता है)। दिए गए तापमान पर वाष्प दाब ज्ञात करने के लिए, क्लॉसियस-क्लैपेरॉन समीकरण का उपयोग करें: एलएन(पी१/पी२) = (ΔHभाप/आर)((1/टी2) - (1/टी1)).
कदम
विधि 1 में से 3: क्लॉसियस-क्लैपेरॉन समीकरण का उपयोग करना
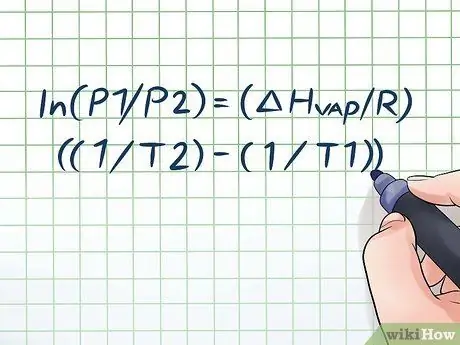
चरण 1. क्लॉसियस-क्लैपेरॉन समीकरण लिखिए।
समय के साथ वाष्प दबाव में परिवर्तन के साथ वाष्प दबाव की गणना करने के लिए इस्तेमाल किया जाने वाला सूत्र क्लॉसियस-क्लैपेरॉन समीकरण कहलाता है (भौतिकविदों रूडोल्फ क्लॉसियस और बेनोइट पॉल माइल क्लैपेरॉन के नाम पर।) यह मूल रूप से वह सूत्र है जिसे आपको अधिकांश प्रकार की समस्याओं को हल करने की आवश्यकता होगी। वाष्प दाब प्रश्न अक्सर भौतिकी और रसायन विज्ञान की कक्षाओं में पाए जाते हैं। सूत्र इस प्रकार है: एलएन(पी१/पी२) = (ΔHभाप/आर)((1/टी2) - (1/टी1)). इस सूत्र में, चर प्रतिनिधित्व करते हैं:
-
एचभाप:
एक तरल के वाष्पीकरण की थैलीपी। यह एन्थैल्पी आमतौर पर रसायन शास्त्र पाठ्यपुस्तक के पीछे तालिका में पाई जा सकती है।
-
आर:
वास्तविक/सार्वभौमिक गैस स्थिरांक, या 8.314 J/(K × मोल)।
-
Q1:
वह तापमान जिस पर वाष्प दाब ज्ञात होता है (या प्रारंभिक तापमान)।
-
टी2:
वह तापमान जिस पर वाष्प का दबाव अज्ञात है/पाना चाहता है (या अंतिम तापमान)।
-
पी1 और पी2:
तापमान T1 और T2 पर वाष्प दाब क्रमशः।

चरण 2. वे चर दर्ज करें जिन्हें आप जानते हैं।
क्लॉसियस-क्लैपेरॉन समीकरण जटिल दिखता है क्योंकि इसमें कई अलग-अलग चर हैं, लेकिन अगर आपके पास सही जानकारी है तो यह वास्तव में उतना मुश्किल नहीं है। अधिकांश बुनियादी वाष्प दबाव समस्याएं तापमान के दो मूल्यों और दबाव के एक मूल्य या दबाव के दो मूल्यों और तापमान के एक मूल्य को सूचीबद्ध करेंगी - एक बार जब आप यह पता लगा लेते हैं, तो इस समीकरण को हल करना बहुत आसान है।
- उदाहरण के लिए, मान लीजिए कि हमें बताया गया है कि हमारे पास 295 K पर तरल से भरा एक कंटेनर है जिसका वाष्प दबाव 1 वायुमंडल (एटीएम) है। हमारा प्रश्न है: 393 K पर वाष्प दाब क्या है? हमारे पास दो तापमान मान और एक दबाव मान है, इसलिए हम क्लॉसियस-क्लैपेरॉन समीकरण का उपयोग करके अन्य दबाव मान पा सकते हैं। अपने चरों को जोड़ने पर, हम प्राप्त करते हैं एलएन(1/पी2) = (ΔHभाप/आर)((1/393) - (1/295)).
- ध्यान दें, क्लॉसियस-क्लैपेरॉन समीकरण के लिए, आपको हमेशा तापमान मान का उपयोग करना चाहिए केल्विन. जब तक P1 और P2 के मान समान हैं, तब तक आप किसी भी दबाव मान का उपयोग कर सकते हैं।

चरण 3. अपने स्थिरांक दर्ज करें।
क्लॉसियस-क्लैपेरॉन समीकरण में दो स्थिरांक हैं: आर और एचभाप. आर हमेशा 8.314 जे/(के × मोल) के बराबर होता है। हालांकि, होभाप (वाष्पीकरण की थैलीपी) उस पदार्थ पर निर्भर करता है जिसका वाष्प दाब आप खोज रहे हैं। जैसा कि ऊपर उल्लेख किया गया है, आप आमतौर पर H. के मान पा सकते हैंभाप रसायन शास्त्र या भौतिकी पाठ्यपुस्तक के पीछे विभिन्न पदार्थों के लिए, या ऑनलाइन (जैसे, उदाहरण के लिए, यहां।)
-
हमारे उदाहरण में, मान लीजिए कि हमारा द्रव है शुद्ध पानी।
यदि हम तालिका में H. के मान देखेंभाप, हम पाते हैं कि Hभाप शुद्ध पानी लगभग 40.65 KJ/mol है। चूँकि हमारा H मान जूल में है, किलोजूल में नहीं, हम इसे में बदल सकते हैं 40,650 जे / मोल।
- हमारे स्थिरांक में प्लगिंग, हम प्राप्त करते हैं एलएन(1/पी2) = (40,650/8, 314)((1/393) - (1/295)).
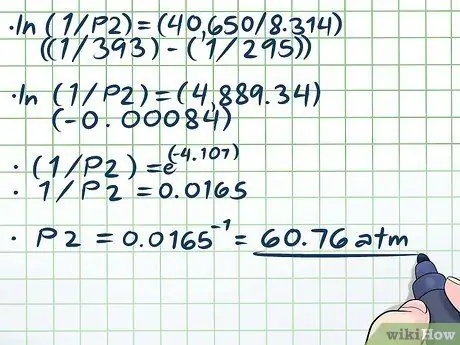
चरण 4. समीकरण को हल करें।
एक बार जब आप समीकरण में सभी चर शामिल कर लेते हैं, जिसे आप खोज रहे हैं, को छोड़कर, साधारण बीजगणित के नियमों के अनुसार समीकरण को हल करने के लिए आगे बढ़ें।
-
हमारे समीकरण को हल करने का एकमात्र कठिन हिस्सा (एलएन(1/पी2) = (40,650/8, 314)((1/393) - (1/295))) प्राकृतिक लॉग (ln) को हल कर रहा है। प्राकृतिक लघुगणक को हटाने के लिए, समीकरण के दोनों पक्षों को गणितीय स्थिरांक e के घातांक के रूप में उपयोग करें। दूसरे शब्दों में, एलएन (एक्स) = 2 → ईएलएन (एक्स) = ई2 → एक्स = ई2.
- अब, हमारे समीकरण को हल करते हैं:
- एलएन(1/पी2) = (40,650/8, 314)((1/393) - (1/295))
- एलएन(१/पी२) = (४८८९, ३४)(-०,०००८४)
- (१/पी२) = ई(-4, 107)
- 1/P2 = 0.0165
-
पी2 = 0.0165-1 = 60, 76 एटीएम।
यह समझ में आता है - एक बंद कंटेनर में, तापमान को लगभग 100 डिग्री (क्वथनांक से लगभग 20 डिग्री ऊपर) तक बढ़ाने से बहुत अधिक भाप पैदा होगी, जिससे दबाव तेजी से बढ़ेगा।
विधि 2 का 3: घुलित विलयन के साथ वाष्प दाब ज्ञात करना
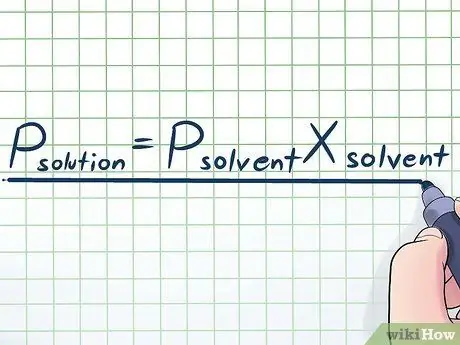
चरण 1. राउल्ट का नियम लिखिए।
वास्तविक जीवन में, हम शायद ही कभी शुद्ध तरल के साथ काम करते हैं - आमतौर पर, हम ऐसे तरल के साथ काम करते हैं जो कई अलग-अलग पदार्थों का मिश्रण होता है। सबसे अधिक उपयोग किए जाने वाले कुछ मिश्रण एक निश्चित रसायन की थोड़ी मात्रा को घोलकर बनाया जाता है जिसे कई रसायनों में घोल कहा जाता है जिसे सॉल्वेंट कहा जाता है। इन मामलों में, राउल्ट्स लॉ (भौतिक विज्ञानी फ्रांकोइस-मैरी राउल्ट के नाम पर) नामक एक समीकरण को जानना उपयोगी है, जो इस तरह लिखा गया है: पीघुला हुआ पदार्थ= पीविलायकएक्सविलायक. इस सूत्र में, चर का प्रतिनिधित्व करते हैं;
-
पीघुला हुआ पदार्थ:
पूरे घोल का वाष्प दाब (सभी तत्व संयुक्त)
-
पीविलायक:
विलायक वाष्प दबाव
-
एक्सविलायक:
विलायक का मोल अंश
- यदि आप मोल फ्रैक्शन जैसे शब्दों को नहीं जानते हैं तो चिंता न करें - हम उन्हें अगले कुछ चरणों में समझाएंगे।

चरण 2. अपने घोल में विलायक और विलेय का निर्धारण करें।
इससे पहले कि आप एक मिश्रित तरल के वाष्प दबाव की गणना कर सकें, आपको उन पदार्थों की पहचान करनी चाहिए जिनका आप उपयोग कर रहे हैं। एक अनुस्मारक के रूप में, एक घोल तब बनता है जब एक विलायक एक विलायक में घुल जाता है - जो रसायन घुलता है उसे हमेशा विलेय कहा जाता है, और जो रसायन इसे घोलता है उसे हमेशा विलायक कहा जाता है।
- आइए इस खंड में सरल उदाहरणों का उपयोग करके उन अवधारणाओं को स्पष्ट करने के लिए काम करें जिन पर हम चर्चा करते हैं। हमारे उदाहरण के लिए, मान लीजिए कि हम चाशनी का वाष्प दाब ज्ञात करना चाहते हैं। परंपरागत रूप से, चाशनी पानी में घुलनशील चीनी (1:1 अनुपात) है, इसलिए हम कह सकते हैं कि चीनी हमारा विलेय है और पानी हमारा विलायक है।
- ध्यान दें कि सुक्रोज (टेबल शुगर) का रासायनिक सूत्र C. है12एच22हे11. यह रासायनिक सूत्र बहुत महत्वपूर्ण होगा।
चरण 3. विलयन का ताप ज्ञात कीजिए।
जैसा कि हमने ऊपर क्लॉसियस क्लैपेरॉन खंड में देखा, एक तरल का तापमान उसके वाष्प दबाव को प्रभावित करेगा। आम तौर पर, तापमान जितना अधिक होता है, वाष्प का दबाव उतना ही अधिक होता है - जैसे-जैसे तापमान बढ़ता है, अधिक तरल वाष्पित हो जाएगा और वाष्प का निर्माण करेगा, जिससे कंटेनर में दबाव बढ़ जाएगा।
हमारे उदाहरण में, मान लें कि इस समय चाशनी का तापमान है २९८ के (लगभग 25 सी)।
चरण 4. विलायक का वाष्प दाब ज्ञात कीजिए।
रासायनिक संदर्भ सामग्री में आमतौर पर इस्तेमाल किए जाने वाले कई पदार्थों और यौगिकों के लिए वाष्प दबाव मान होते हैं, लेकिन ये दबाव मान आमतौर पर केवल तभी मान्य होते हैं जब पदार्थ का तापमान 25 C/298 K या उसका क्वथनांक हो। यदि आपके समाधान में इनमें से एक तापमान है, तो आप एक संदर्भ मान का उपयोग कर सकते हैं, लेकिन यदि नहीं, तो आपको उस तापमान पर वाष्प का दबाव खोजने की आवश्यकता होगी।
- क्लॉसियस-क्लैपेरॉन मदद कर सकता है - क्रमशः पी1 और टी1 के लिए संदर्भ वाष्प दबाव और 298 के (25 सी) का उपयोग करें।
- हमारे उदाहरण में, हमारे मिश्रण का तापमान 25 C है, इसलिए हम आसानी से अपनी आसान संदर्भ तालिका का उपयोग कर सकते हैं। हम जानते हैं कि 25 C पर जल का वाष्प दाब का होता है 23.8 मिमी एचजी

चरण 5. अपने विलायक का मोल अंश ज्ञात कीजिए।
इससे पहले कि हम इसे हल कर सकें, आखिरी चीज जो हमें करने की ज़रूरत है, वह है हमारे विलायक के मोल अंश का पता लगाना। मोल अंश ढूँढना आसान है: बस अपने यौगिकों को मोल में बदलें, फिर पदार्थ में मोल की कुल संख्या में प्रत्येक यौगिक का प्रतिशत ज्ञात करें। दूसरे शब्दों में, प्रत्येक यौगिक का मोल अंश बराबर होता है (यौगिक के मोल)/(पदार्थ में मोलों की कुल संख्या)।
-
मान लीजिए कि चीनी की चाशनी के लिए हमारा नुस्खा उपयोग करता है 1 लीटर (एल) पानी और 1 लीटर सुक्रोज (चीनी)।
इस स्थिति में, हमें प्रत्येक यौगिक के मोलों की संख्या ज्ञात करनी चाहिए। ऐसा करने के लिए, हम प्रत्येक यौगिक का द्रव्यमान ज्ञात करेंगे, फिर पदार्थ के दाढ़ द्रव्यमान का उपयोग इसे मोल में बदलने के लिए करेंगे।
- द्रव्यमान (1 लीटर पानी): 1,000 ग्राम (जी)
- द्रव्यमान (कच्ची चीनी का 1 लीटर): लगभग 1,056, 8 ग्राम
- मोल (पानी): 1,000 ग्राम × 1 mol/18.015 g = 55.51 mol
- मोल्स (सुक्रोज): 1,056, 7 ग्राम × 1 मोल / 342.2965 ग्राम = 3.08 मोल (ध्यान दें कि आप सुक्रोज के दाढ़ द्रव्यमान को इसके रासायनिक सूत्र, सी से पा सकते हैं।12एच22हे11.)
- कुल मोल: 55.51 + 3.08 = 58.59 mol
- पानी का मोल अंश: ५५, ५१/५८, ५९ = 0, 947
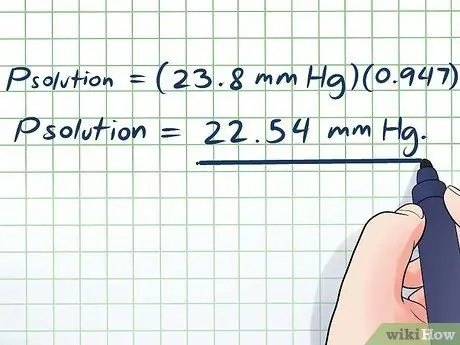
चरण 6. समाप्त करें।
अंत में, हमारे पास राउल्ट के नियम समीकरण को हल करने के लिए आवश्यक सब कुछ है। यह हिस्सा बहुत आसान है: इस खंड की शुरुआत में सरलीकृत राउल्ट के नियम समीकरण में चर के लिए बस अपने मूल्यों को प्लग करें (पीघुला हुआ पदार्थ = पीविलायकएक्सविलायक).
- हमारे मूल्यों में प्रवेश करते हुए, हम प्राप्त करते हैं:
- पीसमाधान = (23.8 मिमी एचजी)(0, 947)
-
पीसमाधान = 22.54 मिमी एचजी।
परिणाम समझ में आता है - तिल के संदर्भ में, बहुत कम पानी में बहुत कम चीनी घुल जाती है (हालांकि वास्तविक दुनिया के संदर्भ में, दोनों अवयवों की मात्रा समान होती है), इसलिए वाष्प का दबाव केवल थोड़ा कम होगा।
विधि 3 का 3: विशेष मामलों में वाष्प दबाव ढूँढना

चरण 1. मानक तापमान और दबाव की स्थिति से सावधान रहें।
वैज्ञानिक अक्सर उपयोग में आसान "मानक" के रूप में तापमान और दबाव मूल्यों के एक सेट का उपयोग करते हैं। इन मूल्यों को मानक तापमान और दबाव (या एसटीपी) कहा जाता है। वाष्प दबाव की समस्याएं अक्सर एसटीपी स्थितियों को संदर्भित करती हैं, इसलिए इन मूल्यों को याद रखना महत्वपूर्ण है। एसटीपी मूल्यों को इस प्रकार परिभाषित किया गया है:
- तापमान: २७३, १५ के / 0 सी / 32 एफ
- दबाव: 760 मिमी एचजी / 1 एटीएम / १०१, ३२५ किलोपास्कल

चरण 2. अन्य चरों को खोजने के लिए क्लॉसियस-क्लैपेरॉन समीकरण को पुनर्व्यवस्थित करें।
भाग 1 में हमारे उदाहरण में, हमने देखा कि क्लॉसियस-क्लैपेरॉन समीकरण शुद्ध पदार्थों के लिए वाष्प दबाव खोजने के लिए बहुत उपयोगी है। हालांकि, सभी प्रश्न आपको P1 या P2 की तलाश करने के लिए नहीं कहेंगे - कई आपसे तापमान मान या कभी-कभी H मान भी खोजने के लिए कहेंगे।भाप. सौभाग्य से, इन मामलों में, सही उत्तर प्राप्त करना केवल समीकरण को पुनर्व्यवस्थित करने का मामला है ताकि आप जिन चरों को हल करना चाहते हैं वे बराबर चिह्न के एक तरफ अलग हों।
- उदाहरण के लिए, मान लें कि हमारे पास २७३ K पर २५ torr के वाष्प दबाव और ३२५ K पर १५० torr के वाष्प दबाव के साथ एक अज्ञात तरल है, और हम इस तरल के वाष्पीकरण की थैलीपी को खोजना चाहते हैं (ΔHभाप) हम इसे इस तरह हल कर सकते हैं:
- एलएन(पी१/पी२) = (ΔHभाप/आर)((1/टी2) - (1/टी1))
- (ln(P1/P2))/((1/T2) - (1/T1)) = (ΔHभाप/आर)
- आर × (एलएन(पी1/पी2))/((1/टी2) - (1/टी1)) = एचभाप अब, हम अपने मान दर्ज करते हैं:
- 8, 314 जे/(के × मोल) × (-1, 79)/(-0, 00059) = एचभाप
- 8, 314 जे/(के × मोल) × 3,033, 90 = एचभाप = २५,२२३, ८३ जे/मोल

चरण 3. जब पदार्थ वाष्प उत्पन्न करता है तो विलेय के वाष्प दाब की गणना करें।
ऊपर हमारे राउल्ट लॉ उदाहरण में, हमारा विलेय, चीनी, सामान्य तापमान पर अपने आप कोई दबाव नहीं डालता (सोचें - पिछली बार आपने अपने ऊपरी अलमारी में एक कटोरी चीनी को वाष्पित होते देखा था?) हालांकि, जब आपके विलेय ने किया था वाष्पित करें, यह आपके वाष्प दबाव को प्रभावित करेगा। हम इसके लिए राउल्ट के नियम समीकरण के संशोधित संस्करण का उपयोग करते हैं: पीसमाधान = (पीयौगिकएक्सयौगिक) प्रतीक सिग्मा (Σ) का अर्थ है कि हमें अपना उत्तर प्राप्त करने के लिए केवल विभिन्न यौगिकों के सभी वाष्प दबावों को जोड़ना होगा।
- उदाहरण के लिए, मान लें कि हमारे पास दो रसायनों से बना एक घोल है: बेंजीन और टोल्यूनि। समाधान की कुल मात्रा 12 मिलीलीटर (एमएल) है; 60 एमएल बेंजीन और 60 एमएल टोल्यूनि। घोल का तापमान 25°C है और इनमें से प्रत्येक रसायन का 25°C पर वाष्प दाब बेंजीन के लिए 95.1 mm Hg और टोल्यूनि के लिए 28.4 mm Hg है। इन मानों के साथ विलयन का वाष्प दाब ज्ञात कीजिए। हम अपने दो रसायनों के लिए मानक घनत्व, दाढ़ द्रव्यमान और वाष्प दबाव मूल्यों का उपयोग करके इसे निम्नानुसार कर सकते हैं:
- द्रव्यमान (बेंजीन): ६० एमएल = ०.०६० एल और गुणा ८७६.५० किग्रा/१,००० एल = ०.०५३ किग्रा = 53 ग्राम
- द्रव्यमान (टोल्यूनि): 0.060 एल और बार 866, 90 किग्रा/1,000 एल = 0.052 किग्रा = ५२ ग्राम
- मोल (बेंजीन): 53 ग्राम × 1 मोल/78, 11 ग्राम = 0.679 मोल
- मोल (टोल्यूनि): ५२ ग्राम × १ मोल/९२, १४ ग्राम = ०.५६४ मोल
- कुल मोल: ०.६७९ + ०.५६४ = १.२४३
- मोल अंश (बेंजीन): 0.679/1, 243 = 0.546
- तिल अंश (टोल्यूनि): 0.564/1, 243 = 0.454
- हल: पीसमाधान = पीबेंजीनएक्सबेंजीन + पीटोल्यूनिएक्सटोल्यूनि
- पीसमाधान = (९५.१ मिमी एचजी)(०, ५४६) + (२८.४ मिमी एचजी)(०, ४५४)
- पीसमाधान = 51.92 मिमी एचजी + 12.89 मिमी एचजी = 64, 81 मिमी एचजी
टिप्स
- ऊपर क्लॉसियस क्लैपेरॉन समीकरण का उपयोग करने के लिए, तापमान को केल्विन (के रूप में लिखा गया) में मापा जाना चाहिए। यदि आपके पास सेल्सियस में तापमान है, तो आपको इसे निम्न सूत्र का उपयोग करके परिवर्तित करना होगा: टीक = २७३ + टीसी
- उपरोक्त विधियों का उपयोग किया जा सकता है क्योंकि ऊर्जा लागू गर्मी की मात्रा के बिल्कुल समानुपाती होती है। तरल का तापमान एकमात्र पर्यावरणीय कारक है जो वाष्प के दबाव को प्रभावित करता है।







